Co znajdziesz w artykule?
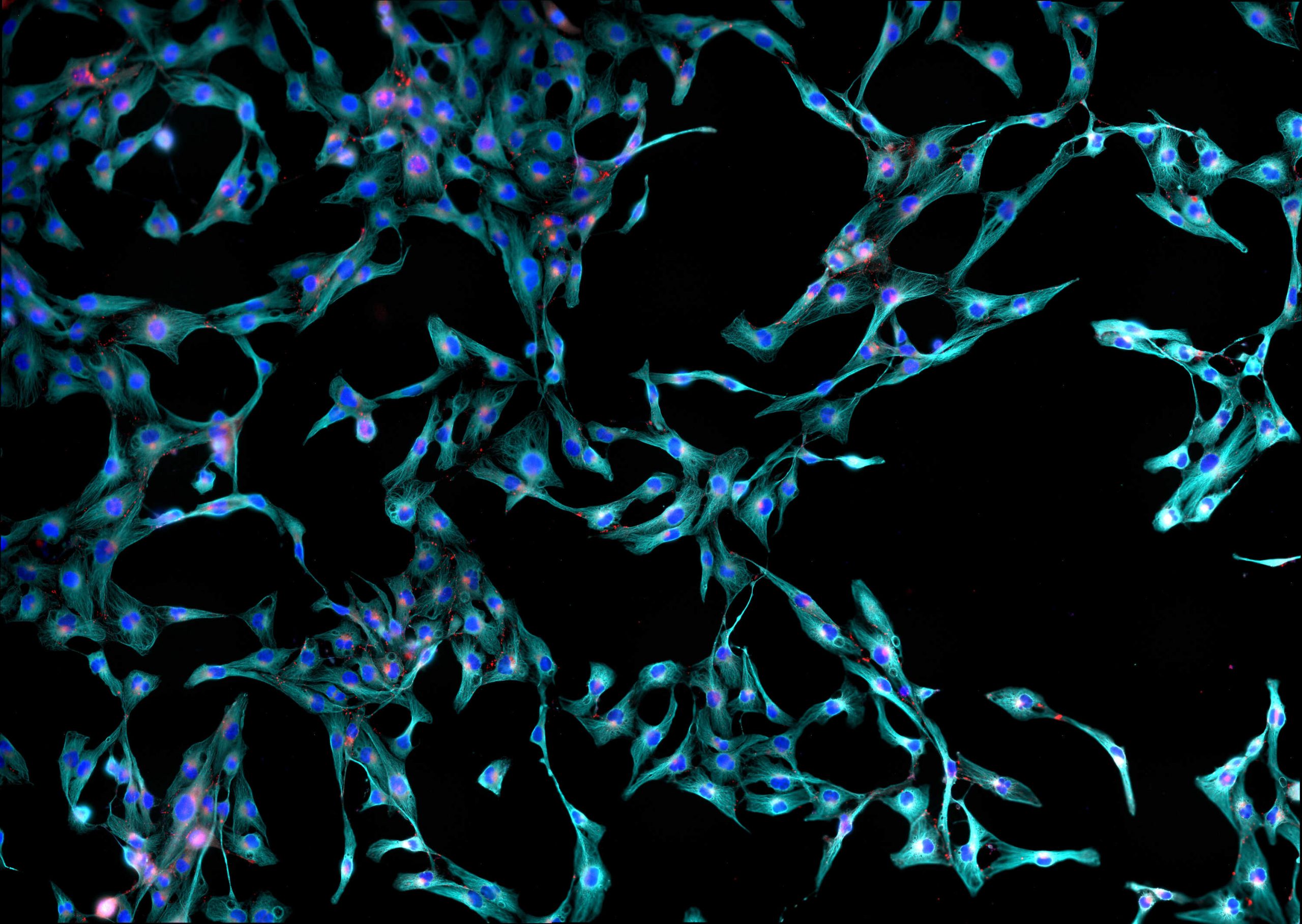
Fibroblasty skóry są dynamiczną i różnorodną populacją komórek, których funkcje nie do końca zostały poznane. Skóra dorosłego człowieka zawiera przynajmniej trzy różne subpopulacje fibroblastów. Jako komórki tkanki łącznej wiążą się ze stabilnością mechaniczną skóry. Wraz ze starzeniem się dojrzałe fibroblasty mają tendencję do przeważania nad fibroblastami młodymi. Przez co skóra traci właściwości typowe dla skóry młodej. Obniżenie aktywności fibroblastów jest przyczyną powstawania zmarszczek.
dr n. biol. Kornelia Niemyska
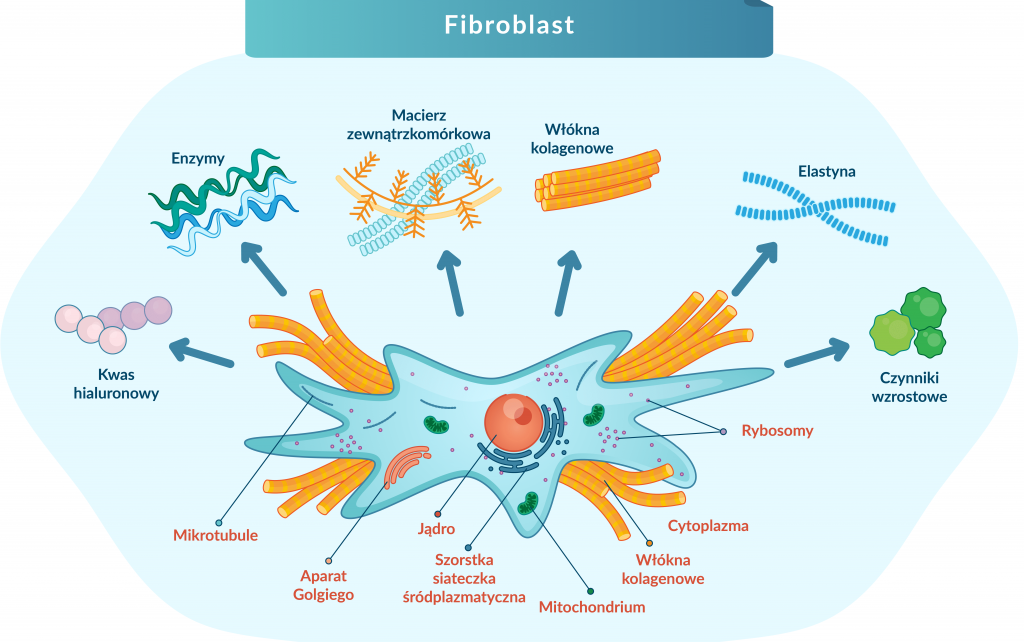
Fibroblasty powstają z komórek tkanki mezenchymatycznej, a ich nazwa wywodzi się z języka łacińskiego fibra – włókno i z języka greckiego blastos – zawiązek, zarodek.
Są to główne komórki tkanki łącznej, komórki kształtu wrzecionowatego lub gwiaździstego. O długich i cienkich wypustkach cytoplazmatycznych, które opierają się o włókna tkanki łącznej.
Charakteryzuje je duża ilość zasadochłonnie barwiącej się cytoplazmy, świadczącej o aktywnej syntezie białka. Duże, owalne jądro z wyraźnym jąderkiem (może być kilka), dobrze rozwinięta siateczka śródplazmatyczna szorstka, aparat Golgiego; oraz wakuole wydzielnicze, świadczące o aktywnym wydzielaniu kolagenu, a także liczne mitochondria.
Oprócz sygnałów autokrynnych fibroblasty silnie reagują na sygnały regulowane przez Wnt z pokrywającego naskórka. Mogące działać zarówno lokalnie, poprzez odkładanie się macierzy zewnątrzkomórkowej (ECM), jak i przez wydzielane czynniki wpływające na zachowanie fibroblastów w różnych lokalizacjach skóry.
Fibroblasty i ich odmiany w skórze
Chociaż wcześniej uważano, że fibroblasty są komórkami homogennymi i w większości nieaktywnymi, coraz częściej uznaje się, że istnieje wiele podtypów fibroblastów o unikatowych funkcjach i morfologii.
Eksperymenty z mapowaniem komórek wykazały, że różnice w embriologicznym pochodzeniu fibroblastów skóry u ludzi zależy od anatomicznej lokalizacji ciała. Na wczesnym etapie rozwoju, fibroblasty progenitorowe mogą się różnicować w kilka typów komórek: fibroblasty skóry, siatkówki, opłucnej czy kości wykazujących różnice metaboliczne.
Fibroblasty znajdujące się w skórze twarzy pochodzą z grzebienia nerwowego, podczas gdy te zlokalizowane w grzbiecie pochodzą z miotomu skóry. A te w obrębie brzusznej skóry właściwej pochodzą z bocznej płytki mezodermy.
Różnice między populacjami manifestują się na różne sposoby: produkcją i organizacją macierzy pozakomórkowej, a także wydzielaniem i odpowiedzią na czynniki wzrostu.
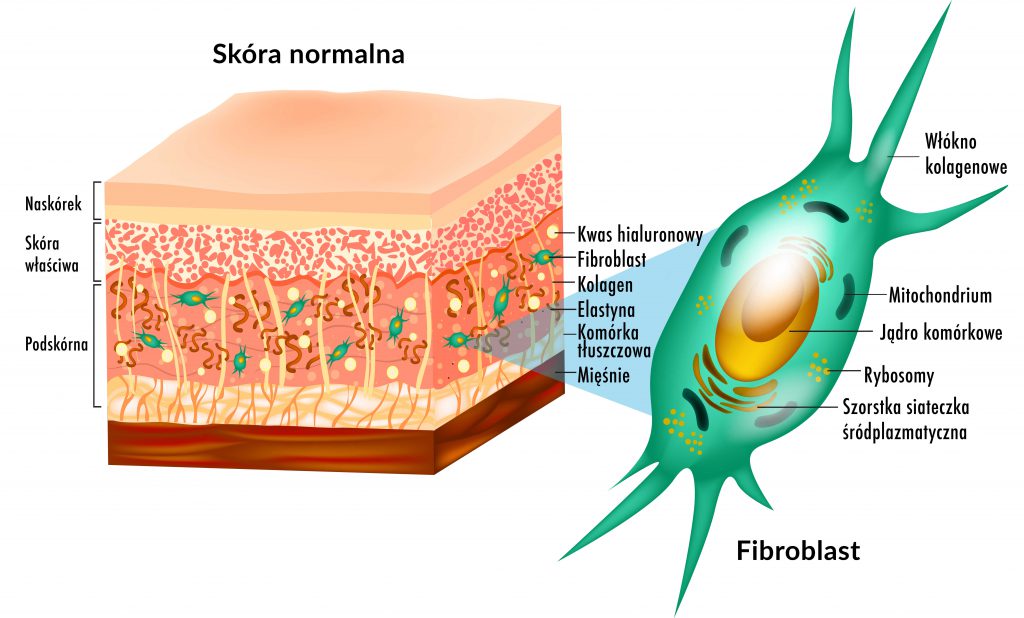
Fibroblasty skóry są dynamiczną i różnorodną populacją komórek, których funkcje nie do końca zostały poznane.
Fibroblasty brodawkowate i siateczkowate można wyizolować przez eksplantację hodowli mechanicznie pociętej (dermatomowanej) ludzkiej skóry właściwej. Skóra dorosłego człowieka zawiera przynajmniej trzy różne subpopulacje fibroblastów.
Dwie subpopulacje znajdują się w odrębnych warstwach skóry: brodawkowatej i siateczkowatej.
Analiza mikromacierzy hodowanych fibroblastów pochodzących z mechanicznie oddzielonej skóry właściwej ujawniła różnice w ekspresji genów.
Eksperymenty z mapowaniem komórek wykazały, że różnice w embriologicznym pochodzeniu fibroblastów skóry u ludzi zależy od anatomicznej lokalizacji ciała. Na wczesnym etapie rozwoju, fibroblasty progenitorowe mogą się różnicować w kilka typów komórek: fibroblasty skóry, siatkówki, opłucnej czy kości wykazujących różnice metaboliczne.
Badania immunohistochemiczne wykazały różnice w ekspresji podtypów kolagenu i proteoglikanów między skórą brodawkowatą i siateczkowatą. Hodowle fibroblastów pochodzące z tych warstw wykazują różnice w wielu parametrach, w tym w szybkości podziału komórek.
Trzecia subpopulacja związana jest z mieszkami włosowymi. Fibroblasty brodawek skórnych mieszków włosowych odgrywają kluczową rolę w rozwoju włosów i koordynacji cyklu włosów.
W starzejącej się skórze
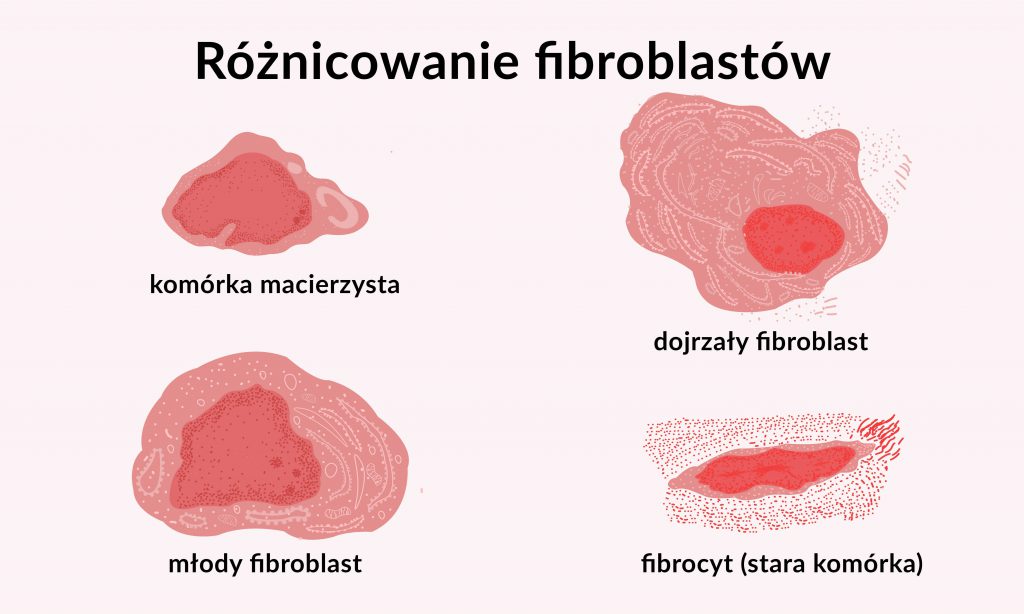
dojrzałe fibroblasty zwane fibrocytami mają tendencję do przeważania nad fibroblastami młodymi. Przez to skóra traci pewne określone właściwości funkcjonalne, typowe dla skóry młodej.
Fibrocyty są komórkami okrągłego kształtu, mniej aktywnymi i sprawnymi metabolicznie. Zawierają wrzecionowate jądra o zbitej chromatynie, kwasochłonną cytoplazmę i zredukowane retikulum endoplazmatyczne. Fibroblasty i fibrocyty są komórkami osiadłymi, ale posiadają zdolność do ruchu.
Komórkami podobnymi do fibroblastów są miofibroblasty, które powstają z miofibroblastów występujących w tkance łącznej. Albo z fibroblastów po uszkodzeniu tkanki, podczas procesów naprawczych. Za tansformację zarówno w warunkach in vitro jak i in vivo odpowiada transformujący czynnik wzrostowy typu B (TFG-B).
Miofibroblasty
są wrzecionowatymi komórkami o dobrze rozwiniętych właściwościach kurczliwych. W odróżnieniu od typowych fibroblastów, na poziomie ultrastrukturalnym w ich cytoplazmie występują filamenty aktynowe związane z miozyną. Zlokalizowane są w tkance łącznej właściwej wielu narządów m.in. w skórze, kosmkach jelitowych. Pełnią one funkcje komórek mięśni gładkich większych naczyń krwionośnych.
Miofibroblasty pojawiają się w procesie gojenia, gdy komórki skóry właściwej wchodzą w szereg interakcji z naskórkowymi keratynocytami. W trakcie procesu gojenia, które trwa zwykle od 1 do 2 tygodni, fibroblasty przechodzą na fenotyp miofibroblastyczny. Charakteryzujący się nagromadzeniem miofilamentów aktynowych rozłożonych wzdłuż błony komórkowej w cytoplazmie komórek.
Miofibroblasty pojawiają się w procesie gojenia, gdy komórki skóry właściwej wchodzą w szereg interakcji z naskórkowymi keratynocytami. W trakcie procesu gojenia, które trwa zwykle od 1 do 2 tygodni, fibroblasty przechodzą na fenotyp miofibroblastyczny.
Wytwarzają one kolagen, a dzięki zdolnościom kurczliwości, powodują obkurczanie tkanki włóknistej w wytwarzającej się bliźnie. Przypuszcza się, że miofibroblasty przyczyniają się do rozwoju sieci naczyń krwionośnych w ranie podczas jej gojenia się.
Transformacja fibroblastów do miofibroblastów jest stymulowana przez czynnik wzrostu i charakteryzuje się zmianami w cytoszkielecie komórek. Zmiana ta dotyczy przede wszystkich znacznego wzrostu ekspresji kurczliwego białka stresowego α-aktyny mięśni gładkich α-SMA (ang. alpha smooth muscle actin), tworzącego włókna wewnątrz fibroblastów. Wykazano, że selektywna eliminacja fibroblastów w skórze prowadzi do opóźnięcia zamknięcia rany.
Aktywność fibroblastów
Podczas swego życia, fibroblasty podlegają zwalniającemu cyklowi podziału komórek, wkraczają w stan senescencji komórkowej, po czym ulegają apoptozie. Liczba podziałów fibroblastów zależy od wieku jak i stanu zdrowia. Prawdopodobnie jest to podyktowane przez genetyczny program starzenia się.
W warunkach hodowli wykazano, że fibroblasty – zanim utracą zdolność podziałów – mogą dzielić się średnio ok. 50 razy. Zakłada się, że od wieku ok. 30 lat liczba podziałów zmniejsza się z każdą dekadą życia o ok. 10%. Wraz z upływem czasu komórki cechuje zmniejszenie zdolności metabolicznych i replikacyjnych, co skutkuje redukcją liczby podziałów.
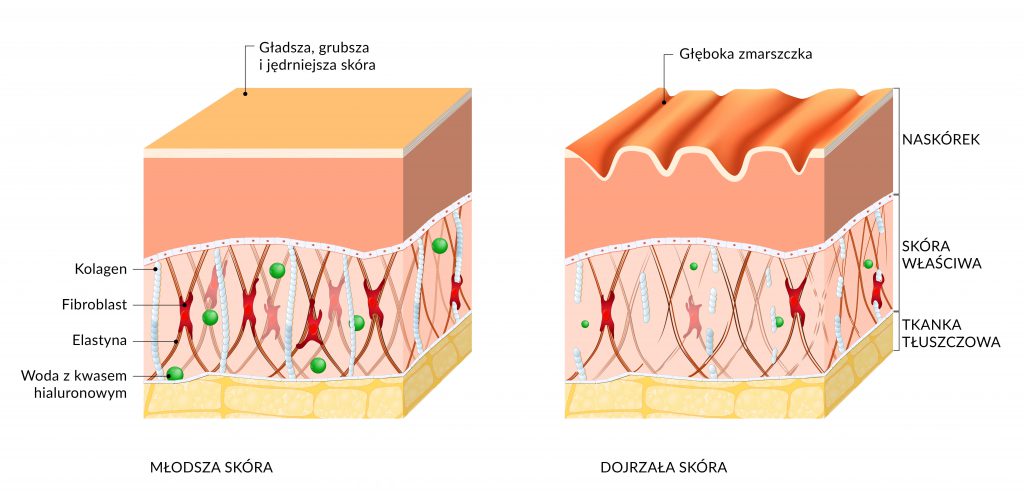
Kolagen i elastyna to dwa białka, które nadają skórze elastyczność, jędrność i odpowiednie napięcie oraz stabilność mechaniczną skóry. Szacuje się, że ok. 75% kolagenu skóry właściwej wytwarzane jest przez fibroblasty, głównie kolagen typu I, III (w stosunku 3:1) oraz mniejsze ilości kolagenu VI.
Ponadto w błonie podstawnej fibroblasty regulują produkcję lamininy i kolagenu typu VII, a także odpowiadają za produkcję proteoglikanów istoty podstawnej, kwasu hialuronowego.
Wydzielają także enzymy z grupy metaloproteaz (MMP – ang. matrix metaloproteinase), które trawią składniki substancji międzykomórkowej. Między innymi kolagenazę hydrolizującą kolagen, głównie typu I, II, III i IV lub stromelizynę przecinającą łańcuchy białek.
Komórki człowieka w warunkach in vitro charakteryzuje ograniczona liczba pokoleń (tzw. okres przeżywania, life-span). W związku z tym dzielą się one zazwyczaj do 50 razy. Wraz z upływem czasu, komórki cechuje zmniejszenie zdolności metabolicznych i replikacyjnych, co skutkuje redukcją liczby podziałów.
Podczas swego życia, fibroblasty podlegają zwalniającemu cyklowi podziału komórek, wkraczają w stan senescencji komórkowej, po czym ulegają apoptozie. Liczba podziałów fibroblastów zależy od wieku jak i stanu zdrowia. Prawdopodobnie jest to podyktowane przez genetyczny program starzenia się.
Za wyczerpanie limitu podziałów odpowiadają zarówno białka regulujące przebieg cyklu komórkowego jak również skracanie telomerów (starzenie replikacyjne). Fibrocyty, znajdujące się w stanie senescencji, podlegają istotnym zmianom metabolicznym i morfologicznym. Włączając w nie zmiany w syntezie składników matrycy pozakomórkowej (zmniejszenie syntezy kolagenu i elastyny), wzrost syntezy proteaz. Zwłaszcza metaloproteinaz, katalizujących rozkład kolagenu, elastyny i glikozoaminoglikanów oraz wzrost wydzielania prozapalnych cytokin. Wszystkie te zmiany wykazują wyraźny, negatywny wpływ na skórę, powodując jej wiotkość, podatność na uszkodzenia oraz widoczne starzenie.
Czynniki aktywności fibroblastów
Częstość podziałów mitotycznych fibroblastów zwiększa się pod wpływem czynnika wzrostu podczas gojenia się tkanki łącznej. Do czynników wpływających na aktywność fibroblastów zalicza się:
- FGF (ang. Fibroblast Growth Factor) – czynnik wzrostu fibroblastów wytwarzany przez keratynocyty wzmaga dojrzewanie fibroblastów i produkcję kolagenu tworząc substancję podporową skóry;
- TGF (ang. Transforming Growth Factor) – zespół czynników wzrostu tzw. przekształcających komórki; i jednocześnie pobudzający angiogenezę (tworzenie nowych naczyń w skórze, poprzez wpływ na komórki śródbłonka naczyniowego); również wytwarzany przez komórki naskórka – keratynocyty;
- PDGF (ang. Plateler Growh Factor) – czynnik wzrostu i dojrzewania płytek krwi; działa w kierunku namnażania się fibroblastów i produkcji kolagenu w procesach zapalnych – wydzielany przez płytki krwi;
- IL-1 (ang. Interieukin 1) – interleukina 1, wytwarzana przez monocyty krwi i makrofagi skóry, nazwana cytokiną prozapalną. Nasila procesy zapalne w obrębie skóry i jednocześnie silnie pobudza fibroblasty;
- IL-6 (ang. Interieukin 6) – interleukina 6 produkowana m.in. przez dojrzałe fibroblasty i makrofagi, która pobudza wzrost fibroblastów i nasila wytwarzanie kolagenu; należy również do grupy cytokin nasilających odczyny zapalne.
Hamujący wpływ na namnażanie się fibroblastów oraz na produkcję kolagenu ma wymieniona IL-6. W postaci związanej z surowiczym białkiem blokującym jej funkcję, hamuje ona w pewnych warunkach wzrost fibroblastów i produkcję kolagenu.
Obniżenie aktywności fibroblastów jest przyczyną powstawania utraty jędrności i sprężystości skóry, utraty jej gładkości oraz zmiany owalu twarzy. Nasila się tendencja do tworzenia bruzd i zmarszczek.
Fibroblasty o różnej tożsamości funkcjonalnej
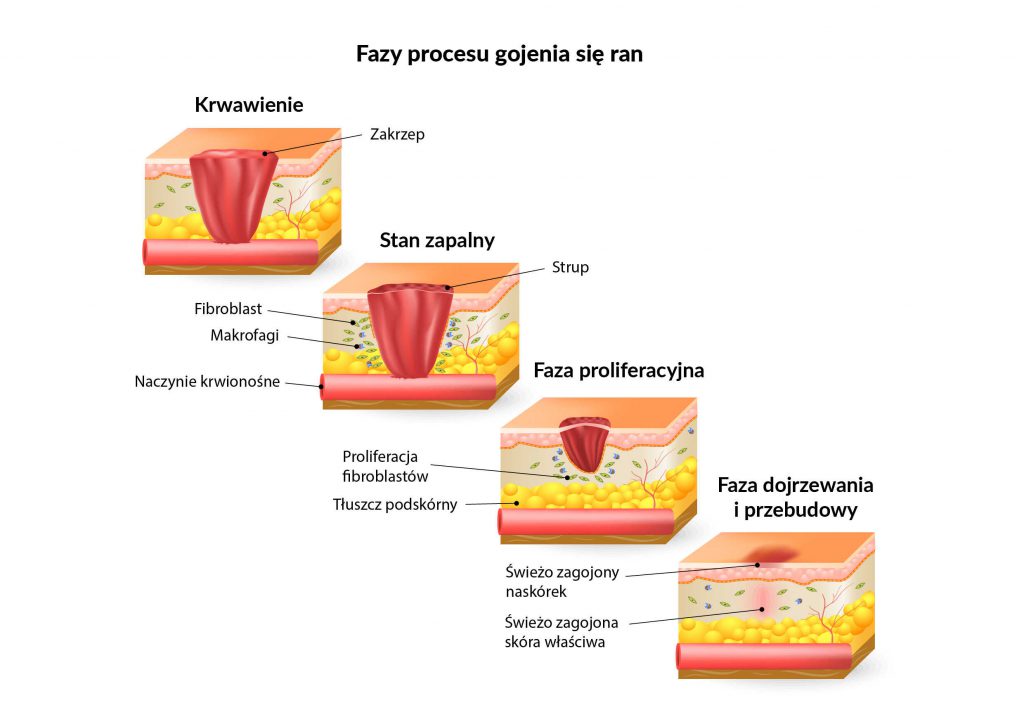
Tkanki ssaków, takie jak skóra właściwa, zawierają fibroblasty o różnej tożsamości funkcjonalnej, co umożliwia zrozumienie szerokiego zakresu stanów patologicznych. W tym chorób charakteryzujących się nadmiernym zwłóknieniem, takich jak blizny, twardzina, nowotwory, a potencjalnie także starzenie się.
Najnowsze dowody podkreślają, że heterogeniczność fibroblastów jest szczególnie istotna podczas gojenia się ran. Obecnie dostępne dowody wskazują, że dostarczanie fibroblastów z górnej warstwy skóry do rany może być ważne w rozwiązywaniu powstawania blizn, ponieważ komórki te zazwyczaj nie przyczyniają się do wczesnej naprawy rany, ale mogą potencjalnie promować regenerację.
Bliznowce charakteryzują się nadmierną proliferacją fibroblastów i odkładaniem się ECM. A fibroblasty pochodzenia keloidowego wykazują różnice w ekspresji i zachowaniu genów w hodowli w porównaniu z fibroblastami ze zdrowej skóry właściwej.
Heterogeniczność fibroblastów jest szczególnie istotna podczas gojenia się ran. Dostarczanie fibroblastów z górnej warstwy skóry do rany może być ważne w rozwiązywaniu powstawania blizn.
Pobudzenie fibroblastów, prowadzące do ich wzmożonej aktywności syntezy kolagenu i innych składników macierzy pozakomórkowej (ECM) zapoczątkowuje proces włóknienia w twardzinie (scleroderma). Identyfikacja unikatowych populacji komórek fibroblastów powodujących zwłóknienie ma istotne znaczenie dla diagnozowania i leczenia chorób.
Czynniki zewnętrzne obniżenia aktywności
Do czynników zewnętrznych wpływających na obniżenie aktywności fibroblastów należy:
- wiek ok. 30 lat;
- ekspozycja na promieniowanie słoneczne (fotostarzenie);
- promieniowanie UV.
Skóra zazwyczaj ulega starzeniu szybciej niż pozostałe narządy, ponieważ jest bezpośrednio narażona na destrukcyjne działanie czynników zarówno wewnętrznych, jak i zewnętrznych. Degradacja włókien elastynowych, jest wynikiem zmniejsza się ilość fibroblastów, a co za tym idzie zmniejszonej produkcji kolagenu.
Ekspozycja na promieniowanie słoneczne skutkuje przyspieszeniem procesu starzenia się skóry na poziomie wszystkich jej warstw. Najbardziej niebezpieczne jest promieniowanie UVA oraz UVB ponieważ indukują proces tworzenia wolnych rodników, które mogą zainicjować proces apoptozy fibroblastów i keratynocytów.
Promieniowanie UVA i UVB aktywuje metaloproteinazy – enzymy produkowane przez fibroblasty, regulujące procesy regeneracji skóry. A ich nadmierna aktywność prowadzi do niszczenia kolagenu. Co za tym idzie utraty jędrności skóry i powstawanie głębokich zmarszczek.
Promieniowanie UVA ma zdolność penetrowania aż do warstwy siateczkowej i brodawkowej skóry. Oddziałując na fibroblasty, komórki dendryczne skóry, komórki śródbłonka naczyniowego oraz na limfocyty T, komórki tuczne i granulocyty. Po naświetleniu dawką 140 mJ/cm2 przeżywa tylko 56% fibroblastów. Co jest spowodowane prawdopodobnie peroksydacją lipidów błony komórkowej, uszkodzeniem DNA i zahamowaniem proliferacji.
Promieniowanie UVA i UVB aktywuje metaloproteinazy – enzymy produkowane przez fibroblasty, regulujące procesy regeneracji skóry. A ich nadmierna aktywność prowadzi do niszczenia kolagenu. Co za tym idzie utraty jędrności skóry i powstawanie głębokich zmarszczek.
Wykorzystując fibroblasty można określić szybkość naprawy uszkodzonego (np. w wyniku ekspozycji na promieniowanie ultrafioletowe) materiału genetycznego. Najczęściej zachowanie się komórek w obecności określonego czynnika oceniane jest na podstawie podziału tychże komórek, co odzwierciedla ich aktywność życiową.
Starczy fenotyp wydzielniczy
Istnieją sugestie, że starzenie się komórek zapobiega powstawaniu z nich nowotworów. Z drugiej strony jednak stare ludzkie fibroblasty pobudzają wzrost nabłonkowych komórek nowotworowych, chociaż nie mają wpływu na komórki prawidłowe. Efekt ten mógł być wywołany zarówno przez bezpośredni kontakt starych fibroblastów i komórek nowotworowych jak i przez rozpuszczalne czynniki wytwarzane przez stare fibroblasty.
Zjawisko to określono jako „starczy fenotyp wydzielniczy” (senescence – associated secretory phenotype, SASP). Stare fibroblasty wydzielają około 40 substancji, z których niektóre, jak np. interleukiny, cząsteczki adhezji międzykomórkowej, czynniki wzrostu i hormony pobudzają wzrost nowotworów.
Ciąg dalszy artykułu w części 2
Kornelia Niemyska
Doktor nauk biologicznych, wykładowca akademicki, autorka publikacji z obszaru nauk medycznych i nauk o zdrowiu.
Bibliografia dostępna w redakcji