Co znajdziesz w artykule?
Proces starzenia się skóry rozpoczyna się początkowo w niewidoczny sposób, około 25–30 roku życia. Cechuje się indywidualnym charakterem zmian i ich przebiegiem, a wiek metrykalny często odbiega od wieku biologicznego. Na patomechanizm starzenia się składa się wiele hipotez i teorii, które wzajemnie się ze sobą wiążą.
Część 1 artykułu – TUTAJ
dr n. biol. Kornelia Niemyska
Starzenie chronologiczne
Teoria ograniczonej liczby podziałów komórki zakłada, że w wyniku starzenia chronologicznego wraz z wiekiem ulegają skróceniu telomery. Telomery zbudowane są z kilkuset podwójnych powtórzeń krótkich sekwencji (tymina-adenozyna-guanina). Udowodniono na przykładzie podziałów mitotycznych fibroblastów, że naturalne i progresywne skracanie telomerów wynosi około 50 par zasad na podział.
Za utrzymanie długich telomerów odpowiedzialny jest enzym telomeraza, którego aktywność powoduje wydłużenie skracających się z każdym podziałem telomerów. Stabilizacja długości telomerów zapewnia komórkom zdolność do nieograniczonego wzrostu, co stwierdzono na przykładzie nowotworów. U ok. 90% komórek nowotworowych, w których stwierdzono intensywną aktywność telomerazy był to czynnik warunkujący ich niekontrolowaną ekspansję.
Proces starzenia komórek
in vitro został dokładnie poznany. Wykazano, że potencjał podziałowy komórek pobranych z organizmów w różnym wieku jest odmienny. Im młodszy jest dawca, tym więcej podziałów mogą przejść jego komórki in vitro.
Starzenie komórkowe ma miejsce zarówno in vitro jak i in vivo. Prawidłowe fibroblasty dzielą się kilkadziesiąt razy w warunkach in vitro, następnie obumierają. Limit Hayflicka zakłada, że zdolność podziałów komórki jest ograniczona i wraz z upływem lat zmniejsza się.
Wykazano doświadczalnie, że komórki przechodzą około 50-60 podziałów po czym ulegają programowej śmierci przy współudziale białka p53. Apoptoza jest procesem fizjologicznym warunkującym prawidłowe funkcjonowanie organizmu, zarówno na etapie embrionalnym, jak i w późniejszym okresie.
Programowana śmierć komórki jest procesem czynnym, wymagającym aktywacji wielu genów oraz nakładu energii. W zależności od rodzaju komórki oraz czynnika indukującego, proces ten może przebiegać w różny sposób, angażując odmienne organelle komórkowe.
Dwie najlepiej poznane ścieżki to szlak zewnętrzny (receptorowy), związany z błoną komórkową oraz wewnętrzny przebiegający z udziałem mitochondrium. Wśród innych dróg sygnałowych apoptozy wymienia się również zaobserwowany w cytotoksycznych limfocytach T oraz komórkach NK – szlak pseudoreceptorowy angażujący perforyny i granzym B; szlak sfingomielinowo-ceramidowy; oraz opisany w 2000 r. związany z reticulum endoplazmatycznym szlak indukowany stresem.
Odgrywa ono istotną, a nawet kluczową rolę w procesie starzenia organizmu i pojawianiu się chorób związanych z wiekiem. Starzenie komórkowe chroni przed proliferacją uszkodzonych komórek, stanowiąc barierę przeciwnowotworową oraz przeciwstarzeniową dla całego organizmu.
Nagromadzenie uszkodzeń w komórkach, spadek efektywności systemów naprawczych komórki oraz zaburzone usuwanie uszkodzonych komórek, skutkuje akumulacją komórek starych. Z jednej strony zahamowanie proliferacji tych komórek pełni rolę przeciwnowotworową. A z drugiej komórki stare pogarszają funkcjonowanie sąsiadujących tkanek, podnoszą stan zapalny, co sprzyja starzeniu się całego organizmu.
Teoria genowa zakłada,
że najdłuższy możliwy czas trwania życia MLS (maximum life span) dla człowieka wynosi około 110–120 lat. Oceniono, że długość życia w 25% zależy od czynników genetycznych, natomiast w 75% od środowiskowych.
W badaniach przeprowadzonych na zamrożonych przez 30 lat ludzkich fibroblastach, które odmrażano partiami wykazano, że komórki te cechują się nie tylko pamięcią objawiającą się konsekwentną realizacją wytyczonego im programu życiowego. Ale również zakodowanym w każdej z nich terminem końca życia. Zjawisko „pamięci komórkowej” powoduje opóźnienie produkowania przez komórki skóry nowych włókien podporowych i zmniejszenie zdolności regeneracyjnych naskórka.
Teoria zaburzeń białkowych udowadnia, że wraz z wiekiem możliwości syntezy białek maleją o około 20–80%, co upośledza sprawne funkcjonowanie organizmu.
Teoria błonowa (membranowa) przedstawia, że w miarę starzenia się organizmu zmienia się skład błon komórkowych. Dotyczy to zwiększenia zawartości lipidów kosztem wody, co w znacznym stopniu utrudnia przezbłonowy transport substancji.
Według teorii mitochondrialnej śmierć komórek może się wiązać z zaburzeniami w obrębie mitochondriów. Ponieważ wraz z wiekiem maleje ich liczba oraz aktywność, co powoduje zmniejszenie wytwarzania adenozynotrifosforanu (ATP). Charakter i zakres zmian morfologicznych jak i biochemicznych komórek podczas procesu starzenia się jest uzależniony od specyficzności tkanek.
Fotostarzenie
Fotostarzenie, czyli starzenie się skóry pod wpływem nadmiernej ilości światła, jest nasilane przez inne czynniki środowiskowe, takie jak dym tytoniowy, zanieczyszczenia powietrza, klimat oraz promieniowanie UV. Określenie fotostarzenie opisuje wiele destrukcyjnych zmian w wyglądzie, funkcji i strukturze skóry, spowodowanych przez nadmierną i długotrwałą ekspozycję na promieniowanie ultrafioletowe oraz sztuczne promieniowanie UV, np. w solarium.

Za fotostarzenie jest odpowiedzialne promieniowanie UVA (długość fali 320–400 nm) oraz UVB (długość fali 290–320 nm). Około 50% promieniowania UVA dociera do warstwy brodawkowatej i siateczkowatej skóry właściwej. Gdzie wpływa na fibroblasty, komórki dendrytyczne, komórki nacieku zapalnego, limfocyty T, granulocyty i komórki tuczne oraz komórki śródbłonka naczyniowego.
UVB jest zatrzymywane w 90% przez warstwę rogową naskórka, lecz około 9–14% dociera do jego warstwy żywej.
Przenikanie promieniowania UV przez skórę doprowadza do szkodliwych skutków ubocznych. Uzależnionych od jego natężenia, długości fali oraz częstości ekspozycji, jak również od występowania oparzeń posłonecznych. Istotna jest zależność działania UV na fototyp skóry, głównie klasy I i II. Według Leccia i wsp., głównym efektem ekspozycji promieniowanie UV na poziomie komórkowym jest uszkodzenie DNA.
Podczas promieniowania UVB dochodzi do reakcji natychmiastowej, związanej z powstaniem wolnych rodników tlenowych (ROS), które przyczyniają się do denaturacji błon komórkowych. Uwalniane są mediatory zapalne (IL-1, IL-6), histamina, serotonina, prostaglandyny; rozszerzają się naczynia włosowate, pojawia się obrzęk i rumień.
Promieniowanie UVA odpowiedzialne jest za natychmiastową reakcję rumieniową oraz przyczynia się do reakcji fotoalergicznych. Promieniowanie UVA wzmacnia w obrębie naskórka działania promieniowania UVB, co powoduje uszkodzenie tkanki łącznej.
Ho i wsp. oraz Shin i wsp. w swoich pracach podają, że w odpowiedzi na przewlekłe działanie UVB fibroblasty skórne wytwarzają enzymy metloproteinazy (MMP-1, MMP-2, MPP-9) zaangażowane w degradację kolagenu typu 1.
Elastoza
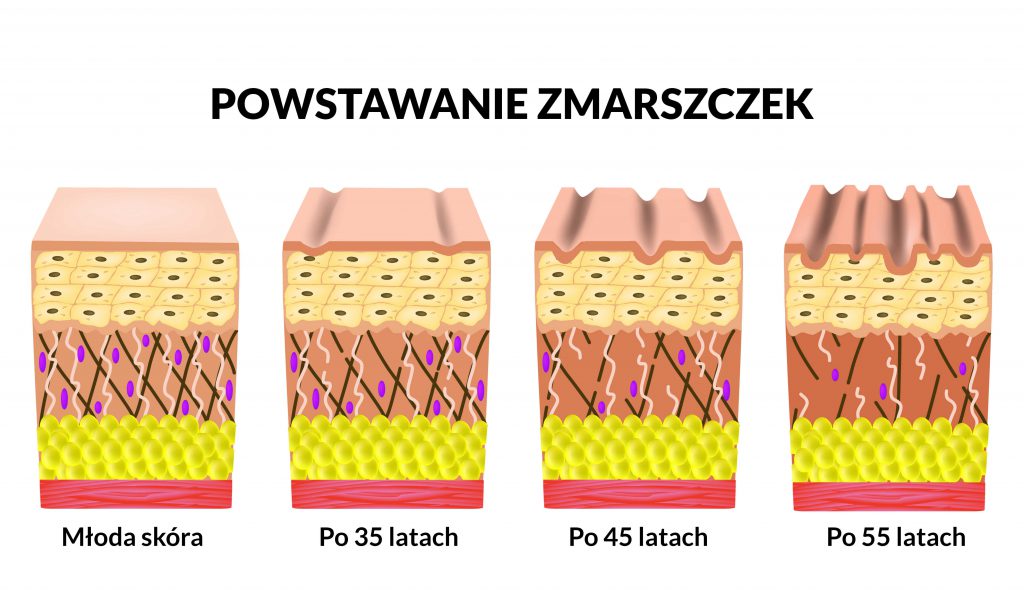
Najbardziej powszechną zmianą histologiczną jest elastoza, tzn. nagromadzenie atroficznego materiału elastynopodobnego w warstwie brodawkowatej skóry właściwej. Może objawiać się to głębokimi bruzdami, guzkami, grudkami. Naskórkowe zmiany to przede wszystkim wzrost grubości warstwy rogowej z towarzysząca atypią cytologiczną.
Zmiany histologiczne, fizjologiczne i biochemiczne w różnych warstwach skóry są znacznie bardziej wyraźne. Do głównych objawów fotostarzenia można zaliczyć: zmiany o charakterze przerostowym, suchość i szorstkość skóry, występowanie zmian przednowotworowych, czyli rogowacenie słoneczne, zmarszczki głębokie, teleangiektazje.
Następne skutki to zmniejszenie elastyczności, wiotkość skóry, przerost gruczołów łojowych, co przyczynia się do tworzenia dużych zaskórników. Skóra staje się żółtobrunatna, szorstka z licznymi przebarwieniami.
Skutki biologicznego oddziaływania na skórę promieniowania UV mogą ujawnić się bezpośrednio po ekspozycji albo po wielu latach. Poza fotostarzeniem się skóry, promieniowanie ultrafioletowe powoduje również obniżenie funkcji immunologicznych – immunosupresję oraz stymulację rozwoju nowotworów – kancerogenezę.
Ostatnia część artykułu wkrótce!
Kornelia Niemyska
Doktor nauk biologicznych, wykładowca akademicki, autorka publikacji z obszaru nauk medycznych i nauk o zdrowiu.
Bibliografia
- Marchewka A, Dąbrowski Z, Żołądź J. Fizjologia starzenia się. Profilaktyka i rehabilitacja. Wydawnictwo PWN, Warszawa 2013.
- Olek-Hrab K, Hawrylak A, Czarnecka-Operacz M. Wybrane zagadnienia z zakresu starzenia się skóry. Postępy Dermatologii i Alergologii 2008, vol. 5: 226-234.
- Zaremba T, Oliński R. Oksydacyjne uszkodzenia DNA – ich analiza oraz znaczenie kliniczne. Postępy Biochemii 2010, vol. 56(2):124-138.
- Zegarska B, Woźniak M. Przyczyny wewnątrzpochodnego starzenia się skóry. Gerontologia Polska 2006, vol. 1: 153-159.
- Maarouf M, Maarouf CL, Yosipovitch G, Shi VY. The impact of stress on epidermal barrier function: an evidence-based review. British Journal of Dermatology 2019, vol. 181(6):1129-1137.
- Ostrowska J, Skrzydlewska E. Starzenie – przyczyny i skutki. Polish Journal of Cosmetology 2008, vol. 11(1): 25-39.
- Dana A. Promieniowanie ultrafioletowe jako czynnik indukujący zewnątrzpochodne starzenie się skóry. Polish Journal of Cosmetology 2012, vol.15(3): 27-38.
- Galęba A, Bajurna B. Przedwczesne starzenie się skóry – proces, któremu można zapobiec. Pielęgniarstwo Polskie 2009, vol. 3: 55-57.
- Laurent TC, Laurent UB, Fraser JR. Serum hyaluronan as a disease marker. Annals of Medicine 1996, vol. 28(3): 241-253.
- Rittle L, Fisher GJ. UV-light-induced signal cascades and skin aging. Ageing Research Reviews 2002, vol. 1(4): 705-720.
- Wang AS, Dreesen O. Biomarkers of Cellular Senescence and Skin Aging. Frontiers i Genetics 2018, vol. 23(9): 247.
- Mohiuddin A. Skin aging and modern age anti – aging strategies. Global Journal of Medical Research 2019, vol.19(2): 14-60.
- Morąg M. Budowa, właściwości oraz funkcje kolagenu i elastyny w skórze. Journal of Health Study and Medicine 2017, vol. 2: 77-100.
- Rittle L, Kang S, Voorhees JJ, Fisher GJ. Induction of collagen by estradiol: difference between sun-protected and photodamaged human skin in vivo. Archives of Dermatology 2008, vol. 144(9): 1129-1140.
- Korzeniowska K, Pawlaczyk M. Kwas hialuronowy nie tylko kosmetyk. Farmacja Współczesna 2014, vol. 7: 72-76.
- Wydro D. Starzenie się skóry – aspekty genetyczne, fizjologiczne i patomorfologiczne. Academy of Aesthetic and Anti-Aging Medicine 2009, vol. 2: 52-62.
- Leccia MT, Lebbe C, Claudel JP, Narda M, Basset-Seguin N. New vision in photoprotection and photorepair. Dermatologic Therapy 2019, vol. 9(1): 103-115.
- Czerska M, Mikołajewska K, Zieliński M, Gromadzińska J, Wąsowicz W. Współczesne markery stresu oksydacyjnego. Medycyna Pracy 2015, vol. 66(3): 393-405.
- Sosińska P., Mikuła-Pietrasik J., Książek K. Molekularne podstawy komórkowego starzenia: fenomen liczby Hayflicka 50 lat później. Postępy Higieny i Medycyny Doświadczalnej 2016, vol.70: 231-242.
- Michalak A, Krzeszowiak J, Markiewicz-Górka I. Starzenie się organizmu a stres oksydacyjny oraz zmniejszona sprawność systemów naprawczych. Postępy Higieny i Medycyny Doświadczalnej 2014, vol. 68: 1483-149.
- Hayflick L. Cell aging. Springer Publishing. New York 1980.
- Virchow R. Passive processes. Fatty degeneration, in Cellular Pathology as Based Upon Physiological and Pathological Histology. London, England Dover Publications 1863, 356-382.
- Bratton SB., Walker G., Roberts DL, Cain K, Cohen GM. Caspase 3 cleaves Apaf-1 into an approximately 30 kDa fragment that asssociates with an inappropriately oligomerized and biologically inactive approximately 1,4 MDa apoptosome complex. Cell death and Differentiation 2001, vol. 8: 425-433.
- Mróz P, Młynarczuk I. Mechanizmy indukcji apoptozy i zastosowanie TRAIL w terapii nowotworów. Postępy Biologii Komórki 2003, vol. 30: 113-128.
- Ricci MS, Zong WX. Chemotherapeutic approaches for targeting cell death pathways. Oncologist 2006, vol. 11: 342-357.
- Kacalak-Rzepka A, Bielecka-Grzela S, Klimowicz A, Wesołowska J, Maleszka R. Sucha skóra jako problem dermatologiczny i kosmetyczny. Roczniki Pomorskiej Akademii Medycznej w Szczecinie 2008, vol. 54(3): 54-57.
- Wang F, Garza LA. Kang S, et al. In Vivo Stimulation of De Novo Collagen Production Caused by Cross – linked Hyaluronic Acid Dermal Filler Injections in Photodemaged Human Skin. Archives of Dermatology 2007, vol. 143: 155-163.
- Zabłocka A, Janusz M. Dwa oblicza wolnych rodników tlenowych, Postępy Higieny i Medycyny Doświadczalnej 2008, vol. 62: 118-124.
- Ames BN, Beckman KB. The free radical theory of aging matures. Physiological – Reviews 1998, vol. 78(2): 545-581.
- Ho JN, Lee YH, Park JS, et all. Protective effects of aucubin isolated from Eucommia ulmoides against UVB-induced oxidative stress in human skin fibroblasts. Biological and Pharmaceutical Bulletin 2005, vol. 28(7): 1244-1248.
- Shin D, Lee S, Huang YH, Lim HW, Lee Y, Jang K, Cho Y, Park SJ, Kim DD, Lim CJ. Protective properties of geniposide against UV-B-induced photooxidative stress in human dermal fibroblasts. Pharmaceutical Biology 2018, vol. 56(1): 176-182.
- Urbańska A. Zaburzenia barwinkowe hiperpigmentacyjne jako problem kosmetyczny. Nowa Medycyna 2003, vol. 1: 18-23.
- Campiche R, Trevisan S, Séroul P, Rawlings AV, Adnet C, Imfeld D, Voegeli R. Appearance of aging signs in differently pigmented facial skin by a novel imaging system. Journal of Cosmetic Dermatology 2019, vol. 18(2): 614-627.
- Gwóźdź K.Charakterystyka zmian metabolicznych zachodzących w procesie starzenia się tkanki tłuszczowej. Kosmos 2017, vol. 66(2): 285-295.
- Jagła D, Korzeniowska K, Pawlaczyk M. Skóra kobiet w okresie menopauzy. Farmacja Współczesna 2012, vol. 5: 83-87.
- Pełka M, Broniarczyk-Dyła G. Wpływ menopauzy na strukturę i procesy fizjologiczne skóry. Przegląd Menopauzalny 2008, vol. 6: 319-322.
- Lipka D, Boratyński J. Metaloproteinazy MMP. Struktura i funkcja. Postępy Higieny i Medycyny Doświadczalnej 2008, vol. 62: 328-336.
- Qin Z, Balimunkwe RM, Quan T. Age-related reduction of dermal fibroblast size upregulates multiple matrix metalloproteinases as observed in aged human skin in vivo. British Journal of Dermatology 2017, vol. 177(5): 1337-1348.
- Knochenhauer E, Azziz R. Ovarian hormones and adrenal androgens during a woman’s life span. Journal of the American Academy of Dermatology 2001, vol. 45: 105-115.
- Addor FAS. Beyond photoaging: additional factors involved in the process of skin aging. Clinical, Cosmetic and Investigational Dermatology 2018, vol. 20(11): 437-443.